Pierrick Poisbeau
Professeur des Universités, Institut Universitaire de France, CNRS et Université de Strasbourg, Strasbourg France.
28es Journées Pédiadol la douleur de l’enfant, Journée plénière 7 décembre 2021, Douleurs du Nouveau-né
La reconnaissance de la douleur de l’enfant, sa prise en charge et l’impact chez l’adulte des douleurs pendant les 1000 premiers jours de vie est aujourd’hui une préoccupation de nombreuses équipes de recherche fondamentale et clinique à travers le monde. Comme nous le savons aussi, la douleur de l’enfant a été longtemps en dehors du champ des priorités pour de nombreuses raisons, y compris sociétales. La société savante de référence dans ce domaine, l’International Association for the Study of Pain (IASP), a d’ailleurs implicitement reconnu cette situation en proposant une révision de la définition de la douleur qui intègre (enfin) la douleur des enfants au même titre que tous les êtres sensibles ayant une difficulté pour communiquer et/ou pour être compris (1). Plus inclusive et reconnaissant sa subjectivité, la douleur devient « une expérience sensorielle et émotionnelle désagréable associée à, ou ressemblant à celle associée à, une lésion tissulaire réelle ou potentielle ». On comprend qu’un équilibre a été trouvé entre la vision Cartésienne du corps souffrant (soma) et celle, plus conceptuelle, du sens (sema) que l’on donne à la douleur, une émotion qui nous métamorphose : celle qui constitue notre histoire de vie passée, qui façonne notre présent et notre futur.
De la douleur du nouveau-né, de l’adversité qui grignote le capital de vie future en bonne santé
L’impact à long-terme des douleurs de l’enfant nouveau-né est maintenant bien documenté [voir revue récente (2)]. La douleur fait par exemple partie intégrante de l’environnement du nouveau-né prématuré. Les travaux de recherche croissants dans ce domaine, combinés à l’amélioration des pratiques cliniques, ont permis de réduire significativement les douleurs induites par les soins et de réduire les risques de développer des troubles neurodéveloppementaux. Cette observation est un exemple parfait pour illustrer le concept de l’origine développementale de la santé et des maladies (DOHaD, developmental origins of health and disease) puisque ces nouveau-nés prématurés semblent présenter un risque accru de développer des troubles bio-psycho-sociaux à un âge ultérieur.
Parmi les autres stresseurs environnementaux susceptibles d’affecter la santé des nouveaunés, notre laboratoire s’intéresse à d’autres stimulations sensorielles qui agressent le cerveau en développement de ces enfants pris en charge dans les unités de réanimation néonatale (3-7). L’exposition aux odeurs hospitalières, comme celles issues de solutions hydro-alcooliques (réputées a priori non douloureuses), irritent ainsi le système trigéminal et peuvent induire des douleurs mesurables par l’expression faciale et par l’imagerie de la réponse hémodynamique corticale (8). Parmi les actions bénéfiques mise en œuvre, les soins de développement jouent un rôle fondamental et la présence parentale, à travers le promotion des contacts peau-à-peau ou de l’allaitement, sont autant de facteurs bénéfiques au développement de l’enfant (9-15). Nos travaux les plus récents se sont intéressés en détail aux mécanismes de l’attachement et à l’impact de l’altération du lien mère-enfant dans le contexte de la prématurité.
De l’ocytocine et du bienfait de la dé-distanciation sociale
La séparation maternelle (ou plus largement parentale) est un facteur de stress bien connu pour le nourrisson (10) mais elle varie selon les pays et les pratiques des différents services de réanimation néonatale. La séparation est également source de stress pour les parents retardant l’établissement précoce de liens affectifs et d’attachement (10, 14). Ces liens sont d’ailleurs très dépendants des sécrétions d’ocytocine, une neurohormone essentielle à la reproduction, à l’établissement précoce du lien social entre les parents et le nouveau-né (16) mais qui possède également des propriétés antalgiques (17). Une publication récente de notre collaboratrice Manuela Filippa vient d’ailleurs de montrer que la voix maternelle induit une augmentation salivaire des concentrations d’ocytocine et réduit significativement les douleurs des nouveau-nés (18). Sans lien avec l’ocytocine à ce stade, il est bien connu que la présence des parents semble être associée à une réduction de la douleur pré-procédurale (19). En particulier, l‘étude EPIPPAIN-2 a signalé que la présence des parents était associée à des scores de douleur plus faibles (score de douleur DAN <3) après une ponction veineuse (20). La même étude a également signalé que l’absence des parents avant une piqûre au talon était associée à un manque d’analgésie pré-procédurale (21). Donc, indirectement, la séparation parentale accentue le risque d’inconfort des nouveau-nés et de leurs réponses douloureuses lors des soins. Cette situation est évidemment problématique lorsque l’on sait que la douleur peut altérer profondément le développement cérébral.
En recherche fondamentale, nous avons pu confirmer l’implication majeure de l’ocytocine dans le bon neurodéveloppement du nouveau-né en utilisant un modèle de séparation maternelle néonatale (SMN) chez le rat. En effet, le nouveau-né chez les rongeurs dispose d’un système nerveux « immature », semblable sur le plan du développement à celui d’un nouveau-né prématuré qui naitrait au début du troisième trimestre de grossesse. Ce modèle expérimental nous a permis de montrer l’impact de la SMN sur l’expression durable d’hypersensibilité nociceptive, de troubles de l’adaptation au stress, d’hyperanxiété et de déficit social (22-24). A côté des modifications épigénétiques qui expliquent parfaitement les conséquences à long-terme observées (24), nous avons pu constater très récemment qu’un déficit d’ocytocine dans la période périnatale est responsable des symptômes observés. Ce déficit d’ocytocine installe un système nociceptif plus excitable car les contrôles inhibiteurs impliquant les récepteurs GABA sont moins efficaces pour contrecarrer l’arrivée des messages douloureux. Le dysfonctionnement des systèmes inhibiteurs semble d’ailleurs être maintenu par une réactivité neuroinflammatoire importante dans les circuits de la douleur (22). Ce processus peut être évité en rétablissant ou en optimisant le lien maternel précoce, ou en administrant de l’ocytocine au nouveau-né (22, 24). En lien avec ces résultats sur l’ocytocine en recherche fondamentale, une étude clinique est actuellement en cours pour évaluer le bénéfice de ces interactions parentales précoce sur la douleur du nouveau-né prématuré en mesurant également les réponses corticales par EEG et imagerie cérébrale.
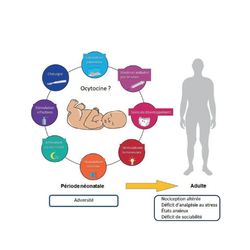
Figure : Représentation graphique des éléments d’adversité précoce qui affectent le développement du système du nouveau-né prématuré. Dans cet article est plus particulièrement analysé le lien entre séparation maternelle, ocytocine, douleurs et conséquences biopsychosociales
En conclusion, les expériences sensorielles précoces des fœtus et en particulier des nouveau-nés prématurés d’âge gestationnel similaire, particulièrement vulnérables, peuvent influencer la trajectoire de leur développement neurosensoriel et cognitif et avoir des conséquences lointaines au cours de la vie. De nombreuses évidences confirment qu’une adversité précoce touchant à la mise en place des liens d’attachement dégrade l’action bénéfique de l’ocytocine sur l’ontogenèse du système nerveux, et tout particulièrement sur les systèmes d’adaptation au stress. Sur le plan clinique, cela renforce la nécessité de mettre en place des stratégies de soins de développement centrés sur l’enfant et sa famille. Au-delà de la trajectoire de santé de ces enfants vulnérables, cela permet également d’optimiser l’ensemble des mécanismes adaptatifs du cerveau dont on sait qu’ils seront essentiels pour minimiser les risques d’apparition de neuropathologies chroniques.
Remerciements : A côté des tutelles CNRS et Universitaires, le programme de recherche présenté dans cet article a été et est encore soutenu par les organismes suivants : Fédération pour la recherche sur le cerveau, Neurogenycs, Strasbourg Pain Initiative (PIA3, ANR-17-EURE-0022, EURIDOL Graduate school of pain). Merci à tous mes collaborateurs Strasbourgeois sans qui cette recherche ne serait pas possible et qui ont, pour ce travail, parfois reçu des prix individuels mérités de la Société Française de Pédiatrie (Dr Jennifer Rondel, Dr Antoine Martenot), de la Société Française d’Etude et de Traitement de la douleur (Prof Pierre Kuhn, Dr Pierre-Eric Juif), de l’Institut Analgesia (Prof. Pierre Kuhn), de la fondation de l’Université de Strasbourg (Dr Meggane Melchior, Dr Géraldine Gazzo).
Bibliographie
1. Raja SN, et al. (2020) The revised International Association for the Study of Pain definition of pain: concepts, challenges, and compromises. Pain.
2. Melchior M, Kuhn P, & Poisbeau P (2021) The burden of early life stress on the nociceptive system development and pain responses. Eur J Neurosci.
3. Kuhn P, Zores C, Astruc D, Dufour A, & Casper C (2011) [Sensory system development and the physical environment of infants born very preterm]. Arch Pediatr 18 Suppl 2:S92-102.
4. Kuhn P, et al. (2013) Moderate acoustic changes can disrupt the sleep of very preterm infants in their incubators. Acta Paediatr 102(10):949-954.
5. Kuhn P, et al. (2012) Infants born very preterm react to variations of the acoustic environment in their incubator from a minimum signal-to-noise ratio threshold of 5 to 10 dBA. Pediatr Res 71(4 Pt 1):386-392.
6. Zores C, et al. (2018) Observational study found that even small variations in light can wake up very preterm infants in a neonatal intensive care unit. Acta Paediatr 107(7):1191-1197.
7. Zores C, et al. (2015) Very preterm infants can detect small variations in light levels in incubators. Acta Paediatr 104(10):1005-1011.
8. Frie J, Bartocci M, Lagercrantz H, & Kuhn P (2018) Cortical Responses to Alien Odors in Newborns: An fNIRS Study. Cereb Cortex 28(9):3229-3240.
9. Charpak N, et al. (2017) Twenty-year Follow-up of Kangaroo Mother Care Versus Traditional Care. Pediatrics 139(1).
10. Flacking R, et al. (2012) Closeness and separation in neonatal intensive care. Acta Paediatr 101(10):1032-1037.
11. Greisen G, et al. (2009) Parents, siblings and grandparents in the Neonatal Intensive Care Unit. A survey of policies in eight European countries. Acta Paediatr 98(11):1744-1750.
12. Grunau RE (2013) Neonatal pain in very preterm infants: long-term effects on brain, neurodevelopment and pain reactivity. Rambam Maimonides Med J 4(4):e0025.
13. Johnston C, et al. (2017) Skin-to-skin care for procedural pain in neonates. Cochrane Database Syst Rev 2:CD008435.
14. Korja R, Latva R, & Lehtonen L (2012) The effects of preterm birth on mother-infant interaction and attachment during the infant’s first two years. Acta Obstet Gynecol Scand 91(2):164-173.
15. Pallas-Alonso CR, et al. (2012) Parental involvement and kangaroo care in European neonatal intensive care units: a policy survey in eight countries. Pediatr Crit Care Med 13(5):568-577.
16. Filippa M, et al. (2019) Pain, Parental Involvement, and Oxytocin in the Neonatal Intensive Care Unit. Front Psychol 10:715.
17. Poisbeau P, Grinevich V, & Charlet A (2018) Oxytocin Signaling in Pain: Cellular, Circuit, System, and Behavioral Levels. Curr Top Behav Neurosci 35:193-211.
18. Filippa M, et al. (2021) Maternal speech decreases pain scores and increases oxytocin levels in preterm infants during painful procedures. Sci Rep 11(1):17301.
19. Carbajal R, et al. (2008) Epidemiology and treatment of painful procedures in neonates in intensive care units. JAMA 300(1):60-70.
20. Courtois E, et al. (2016) The burden of venipuncture pain in neonatal intensive care units: EPIPPAIN 2, a prospective observational study. Int J Nurs Stud 57:48-59.
21. Courtois E, et al. (2016) Epidemiology and neonatal pain management of heelsticks in intensive care units: EPIPPAIN 2, a prospective observational study. Int J Nurs Stud 59:79-88.
22. Gazzo G, et al. (2021) Overexpression of chloride importer NKCC1 contributes to the sensory-affective and sociability phenotype of rats following neonatal maternal separation. Brain Behav Immun 92:193-202.
23. Juif PE, et al. (2016) Peripheral and central alterations affecting spinal nociceptive processing and pain at adulthood in rats exposed to neonatal maternal deprivation. Eur J Neurosci 44(3):1952-1962.
24. Melchior M, et al. (2018) Pharmacological rescue of nociceptive hypersensitivity and oxytocin analgesia impairment in a rat model of neonatal maternal separation. Pain 159(12):2630-2640.
