Cora CRAVERO
Pédopsychiatre, Praticien Hospitalier
Centre Référent Maladies Rares à Expression Psychiatrique, Service de Psychiatrie de l’Enfant et de l’Adolescent, GHU Pitié-Salpêtrière, APHP.SU, Paris
Unité Mobile Interdépartementale 75-92, Situations complexes en autisme, Fondation de l’Elan Retrouvé, Paris
in Les 29èmes Journées Pédiadol, Session : Ajuster son regard aux besoins de chaque enfant
Introduction
L’autisme est un trouble du neurodéveloppement, existant à la naissance et se manifestant dans les premières années de vie de l’enfant. Ses formes cliniques sont multiples et très hétérogènes, et sont regroupées sous le terme de troubles du spectre de l’autisme (TSA). Les TSA sont définis par des troubles de la communication et des interactions sociales et par des intérêts restreints et des comportements stéréotypés,
ainsi que par des troubles de l’intégration sensorielle qui en complètent la définition depuis une dizaine d’années (APA, 2013).
Face à un jeune (enfant, adolescent) avec TSA, ce ne sont pas tant les spécificités des TSA en eux-mêmes qui posent problème (elles sont plutôt bien identifiées, et la volonté de repérage, de diagnostic, d’évaluations et d’interventions précoces porte ses fruits) (Santé, 2012, 2018), que la déficience intellectuelle qui peut être associée (en particulier en cas de déficience intellectuelle sévère ou profonde, et donc de patient n’ayant pas accès au langage), ainsi que les comorbidités somatiques et/ou psychiatriques pouvant également être associées. Il en va de même pour certains troubles du comportement difficiles à gérer (ex : agitation, instabilité psychomotrice, crises clastiques avec cris, jets et bris d’objets, agressivité envers eux-mêmes ou envers les autres), pouvant se complexifier avec le temps jusqu’à devenir des troubles
du comportement graves et sévères (Guinchat et al., 2015).
Je vous propose dans un premier temps de voir comment on peut s’adapter aux particularités de l’enfant avec TSA en consultation et/ou en milieu hospitalier, en adoptant quelques principes simples. Puis, dans un second temps, de présenter les outils et les moyens existants ou innovants pour faciliter le déroulement d’une consultation et de soins avec un enfant avec TSA, agité et difficilement examinable.
Enfin, de nous intéresser plus finement sur le plan clinique à la population la plus complexe et la plus vulnérable, représentée par les enfants et adolescents non ou peu verbaux, avec troubles du comportement sévères, pour lesquels l’apparition ou la recrudescence de certains troubles graves du comportement sont bien souvent l’expression de comorbidités somatiques non diagnostiquées et non ou insuffisamment
traitées (épilepsie – en particulier épilepsies partielles complexes – cause algique).
Nous nous centrerons, grâce à la séméiologie et la topographie évocatrices des troubles du comportement, sur la prise en charge diagnostique et thérapeutique des étiologies douloureuses dans cette population.
S’adapter aux particularités de l’enfant et de l’adolescent avec trouble du spectre autistique (en consultation, à l’hôpital).
Il s’agit de considérer à la fois :
– le niveau de développement de l’enfant ou de l’adolescent (sans déficience intellectuelle ou avec déficience intellectuelle légère, modérée, sévère/profonde) ;
– les spécificités de l’enfant ou de l’adolescent inhérentes au TSA (ex : particularités sensorielles, intérêts spécifiques) ;
– l’intégration et l’expression de la douleur qui peuvent être différentes, ainsi que ses modalités d’évaluation, notamment chez les patients non verbaux ou au langage non fonctionnel.
Ainsi seront pris en compte, autant que faire se peut : les capacités de communication et de compréhension, les particularités dans les interactions sociales, les intérêts spécifiques, les particularités sensorielles, et l’installation du patient adaptée à son niveau de développement sensori-moteur (Kloeckner et al., 2009). Il s’agit donc pour cela, au préalable, d’avoir pensé et agencé un minimum les conditions d’accueil, l’espace, l’architecture et la sécurisation des locaux (Gaines et al., 2018).
Quelques principes simples peuvent être adoptés :
1. En amont de la consultation :
– On peut proposer une consultation « blanche » (sans soins/de repérage), afin que le patient se familiarise avec les lieux et les personnes, et autoriser la famille à photographier la salle d’attente (ce qui pourra servir à réaliser un pictogramme photo par exemple pour les patients nécessitant ce type de communication alternative/facilitée) (Hutchins & Prelock, 2014 ; White et al., 2021).
– Selon le type de soins prévus, le patient peut être préparé à la consultation par l’équipe de l’IME / de l’HDJ ou la famille.
– Il est important de recevoir dans une pièce épurée, sans objet dangereux à jeter, ni moyen pour le patient de se faire du mal.
2. Le jour de la consultation et durant la consultation :
– Pas d’attente si possible, car celle-ci risque d’augmenter l’anxiété et les troubles du comportement.
– Permettre au patient d’exprimer ses stéréotypies motrices et/ou verbales, accepter qu’il vaque à ses intérêts restreints (ex : écouter de la musique, regarder sa tablette, feuilleter son livre…). Les faire préciser par la famille / l’entourage, car certains intérêts électifs pourront
également servir de renforçateurs après des soins réussis (cf. infra).
– En cas d’agitation importante : autoriser le patient à aller déambuler, faire un tour avec un référent/parent puis revenir. Dans certains cas, il m’arrive de consulter dans la cour du service (espace en plein air avec enceinte fermée).
– Selon le niveau de compréhension (s’appuyer sur le bilan de communication s’il a été réalisé ; ex : bilan orthophonique, COMVOOR) (Verpoorten et al., 2012) : annoncer verbalement et/ou par des gestes ce que l’on va faire, en utilisant des phrases simples, montrer sur soi ou
sur un accompagnant. On peut se placer en périphérie du patient (légèrement de côté) plutôt que de face, car les stimulations visuelles périphériques sont mieux perçues (ex : les autostimulations par flapping) (Frey et al., 2013).
– Selon les spécificités en termes d’intégration sensorielle et de traitement des informations sensorielles (se référer au profil sensoriel de Dunn s’il a été réalisé pour le patient) (Dunn, 1999) : aménager l’environnement et, pour le clinicien, la façon de faire selon les hypo- et/ou
les hyper-réactivités sensorielles qu’il présente. En cas d’hyposensibilité ou d’hyporéactivité à une modalité sensorielle, le patient va rechercher des sensations et s’auto-stimuler dans cette modalité sensorielle ; à l’inverse, en cas d’hypersensibilité à une modalité sensorielle, le patient va se mettre en retrait ou éviter activement cette modalité sensorielle, afin d’éviter une surcharge sensorielle et une augmentation du niveau de stress (Posar & Visconti, 2018) :
• adapter la luminosité (canal visuel) ;
• adapter le niveau sonore/le bruit ; mettre ou non une musique (auditif) ;
• avant de procéder à un examen clinique, savoir s’il existe des irritabilités tactiles ou non (tactile) ; des sensibilités particulières au chaud/froid (thermoception) ;
• savoir s’il est nécessaire d’adapter certaines odeurs (olfactif), ou certains goûts (gustatif) ;
• connaître les particularités d’intégration vestibulaire et proprioceptive ;
• se renseigner sur les particularités d’intégration nociceptives lorsqu’elles sont connues. Utiliser des échelles d’évaluation et de localisation de la douleur, se référer à la description de l’état stable du patient, ainsi qu’à l’expression connue de manifestations douloureuses antérieures.
– Enfin, renforcer positivement les bons gestes/réactions du patient quand l’examen clinique ou les soins se sont bien passés, ou à un moment où l’enfant ou l’adolescent est calme. On utilise un renforçateur positif, i.e. un moyen de récompense qui va faire plaisir au jeune et l’inciter à adopter de nouveau la prochaine fois les comportements ayant conduit à la gratification (Granpeesheh et al., 2009) (ex : renforçateur social : bravo, félicitations ! ; sensoriel : musique, vidéo, dessin animé préféré, massage… ; n’utiliser un renforçateur alimentaire qu’en l’absence d’autre renforçateur possible).
Dispositifs d’aide à la réalisation des soins (examen clinique, examen complémentaire) chez l’enfant ou l’adolescent avec TSA agité et difficilement examinable : outils habituels, outils spécifiques et outils innovants.
Il faut savoir avant tout que les troubles organiques et les étiologies douloureuses peuvent être facilement négligés et passer inaperçus chez ces patients. Il y a plusieurs raisons à cela : manque de compliance du sujet, difficultés de communication (absence de langage ou langage présent mais peu fonctionnel, difficultés à exprimer la douleur), perceptions sensorielles et nociceptives atypiques (Dubois et al., 2010), difficultés à localiser la douleur (intégration du schéma corporel souvent limitée) (Whitney & Shapiro, 2019), pathologies mal connues aux tableaux parfois particulièrement complexes (maladies rares, polyhandicap et intrications multiples), pathologies du tout-venant pouvant s’exprimer de manière atypique, et enfin peu ou pas d’exigence du patient (la demande est essentiellement celle des parents, de l’entourage).
Dans cette population, il faut se représenter que la douleur est bien souvent agie (comportementalement) plutôt qu’exprimée (verbalement). Elle se manifeste de manière indirecte par des troubles du comportement qui tranchent avec l’état de fonctionnement habituel du sujet d’une part, et qui sont non contextualisables d’autre part (nous reviendrons sur ce point). Or, face à des troubles du comportement dont l’intensité et la fréquence augmentent au cours du temps, il n’est pas rare en pratique courante que le patient soit adressé préférentiellement en pédopsychiatrie plutôt qu’en pédiatrie. Avec pour conséquence que la réponse thérapeutique soit majoritairement une instauration ou une augmentation de traitements neuroleptiques (non seulement inefficaces dans ces cas-là, mais en plus pourvoyeurs de iatrogénie : sédation marquée, prise pondérale, dyskinésies aiguës, akathisie, constipation… pour ne citer que quelques effets secondaires des neuroleptiques parmi les plus fréquents) (Cohen et al., 2013 ; Cravero et al., 2017), plutôt qu’un effort de recherche des causes pouvant sous-tendre et expliquer la dégradation comportementale (et même cognitivo-comportementale, puisque bien souvent la dégradation comportementale entrave la vie quotidienne et les capacités de fonctionnement du sujet) (Guinchat et al., 2015 ; Guinchat et al., 2020), qui n’est pas inhérente à l’autisme.
L’accès aux soins pour ces enfants et adolescents se trouve ainsi réduit, ne seraitce que parce que la plainte est mal exprimée, que les troubles du comportement entravent le bon déroulé de l’évaluation, et qu’ils orientent faussement d’emblée vers une prise en charge psychiatrique (en partant, pour le dire autrement, du postulat erroné que les troubles du comportement sont forcément d’origine psychiatrique ou développementale), ou encore que les cliniciens sont peu formés à la prise en charge des étiologies algiques chez l’enfant et l’adolescent non verbal, ou sans langage verbal fonctionnel, qui plus est agité, voire violent.
Dans ce contexte, garantir le bon déroulé d’une consultation spécialisée, ainsi que la réalisation d’examens complémentaires nécessaires à la recherche d’une cause douloureuse à l’origine des troubles du comportement, s’avère être un enjeu important.
Figure 1 : Dispositifs d’aide à la réalisation des soins


Parmi les dispositifs d’aide à la réalisation des soins (Figure 1), nous pouvons citer :
1. Outils habituels :
– anxiolyse/sédation réalisée par prémédication ;
– antalgie et anesthésie locale réalisée par crème anesthésiante ou patch transdermique de lidocaïne/prilocaïne (EMLA) avant une prise de sang (ou autre soin douloureux avec effraction cutanée) ;
– anxiolyse et analgésie par Mélange Equimolaire d’Oxygène et Protoxyde d’Azote (MEOPA). Certains patients adorent les effets du MEOPA et recherchent le port du masque MEOPA ;
– anesthésie générale.
2. Outils spécifiques :
– papoose-board : un dispositif médical constitué d’une planche à scratchs matelassée initialement utilisé par les dentistes, permettant d’immobiliser temporairement le corps, les bras et les jambes de l’enfant (Malik et al., 2021). Il permet la réalisation d’examen clinique et/ou d’examens complémentaires (ex : otoscopie, soins dentaires, EEG, scanner, IRM, ECG, PCR nasopharyngé) (How to use an Olympic Papoose-Board : https://www.youtube.com/watch?v=-iFd3mwYy5M) ; (CRAIF, 2020 ; Liberté, 2013), en se passant d’une prémédication, ou en évitant une anesthésie générale ou encore une contention physique « musclée » et anxiogène.
Il peut aussi s’utiliser en association avec une prémédication ou du MEOPA si nécessaire ;
– formations à la prévention des situations de violence et d’agressivité, aux techniques de sécurité personnelle, et à la gestion des crises et des troubles du comportement (ex : Professional Crisis Management Association (PCMA), Oméga…) (PCMA, 2021).
3. Outils innovants :
– une nouvelle version de papoose-board est en cours en France, issue d’un partenariat entre l’APHP.SU, l’Espace Ethique et l’Ecole Normale Supérieure de Création Industrielle
(ENSCI) (https://www.cadredesante.com/spip/profession/profession-cadre/article/laphp-decerne-son-prix-soignant-innovai-a-un-infirmier-de-sante-mentale) ;
– paravent tripartite Hoplon (Novatex Medical) (https://www.novatex-medical.com/wpcontent/themes/novatex/includes/NOVATEX_FLYER_BOUCLIER_HD.pdf) ;
– équipements de protection individuelle (EPI), dans les situations avec auto-agressivité (EPI pour les patients) et/ou hétéro-agressivité importantes (EPI pour les soignants) (Lefèvre-Utile et al., 2018a, 2018b).
Chez l’enfant ou l’adolescent avec déficience intellectuelle non verbal ou peu verbal présentant des troubles du comportement d’apparition récente ou une exacerbation de troubles du comportement, quand et comment rechercher et traiter une cause algique ?
Une étude a été réalisée sur les 70 premières hospitalisations de patients enfants, adolescents et adultes (âge moyen : 15,7 ans ± 4.1 [10.9-37], 76% de sujets masculins) avec TSA, déficience intellectuelle et troubles graves du comportement, dans le service à l’USIDATU (Unité Sanitaire Interdépartementale d’Accueil Temporaire d’Urgence), une unité neurocomportementale dédiée à la prise en charge des situations complexes en autisme en Ile de France (sans limite d’âge), implantée en pédopsychiatrie à l’hôpital de la Pitié-Salpêtrière à Paris. Dans cette étude, nous avons repéré qu’une étiologie somatique constituait la cause principale de la décompensation cognitive et comportementale
dans un tiers des cas (dans 50 % des cas elle était d’origine psychiatrique, dans 20% des cas d’origine environnementale). Par ailleurs, diagnostiquer et traiter une comorbidité somatique ou une comorbidité psychiatrique représentait un facteur prédictif positif d’amélioration à la sortie de l’hospitalisation et prédisait une meilleure évolution clinique.
Enfin, plus les troubles du comportement étaient variés et aigus, plus le risque qu’ils soient associés à des comorbidités était élevé, donc avec un important potentiel d’amélioration, si correctement pris en charge (Guinchat et al., 2015).
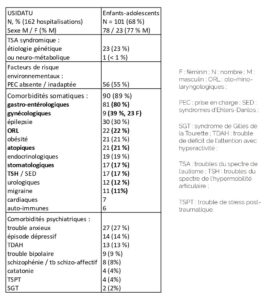
Dans notre cohorte actualisée de patients hospitalisés à l’USIDATU, concernant uniquement les enfants et adolescents (N = 101 hospitalisations, sex ratio masculin (M)/féminin (F) (% M) : 78/23 (77% M)), on retrouve 89% de comorbidités somatiques, en large majorité des causes algiques, en particulier : gastroentérologiques (80%, notamment œsophagites, gastrites, constipations chroniques et syndromes sub-occlusifs), gynécologiques (39%, N = 23 ; les filles sont plus rares en hospitalisation, mais une bonne partie d’entre elles présentent des
problèmes gynécologiques, notamment des infections gynécologiques non traitées), ORL (22%, notamment otites, sinusites), atopiques/allergiques (21%), stomatologiques (17%), troubles du spectre de l’hypermobilité articulaire et syndromes d’Ehlers-Danlos
(17%), urologiques (12%), migraines (11%). D’autres comorbidités, même si elles ne sont pas stricto sensu toujours douloureuses, peuvent être gênantes, à l’origine d’inconfort majeur, et/ou se compliquer : épilepsie (30%), obésité (21%), troubles endocriniens (19%), et sont bien sûr également à rechercher (Tableau 1).
Tableau 1 : Principales comorbidités somatiques (en particulier étiologies algiques) et psychiatriques retrouvées chez les enfants et adolescents hospitalisés à l’USIDATU (N = 101) (Courtesy: Marianna Giannitelli)
Dans une étude cas-témoins (cas : N = 55, témoins : N = 55) d’enfants et adolescents atteints de TSA avec déficience intellectuelle et retard de langage, hospitalisés à l’USIDATU en raison de leurs troubles du comportement aigus, les enfants-adolescents avec TSA présentent un sur-risque de lésions digestives à la fibroscopie œso-gastroduodénale (OR = 4,53 (1,76 – 12,59), p=0.002), en comparaison à la population pédiatrique générale (sans TSA et présentant une douleur abdominale chronique (>3 mois) avec suspicion de lésion organique). Un sur-risque d’œsophagite (OR = 3,33 (1,11 – 11,10), p=0.039) et de gastrite (OR = 2,64 (1,11 – 6,50), p=0.030) a également été retrouvé. Les
lésions retrouvées sont plus fréquemment chroniques et actives sur le plan histologique, sans sur-risque retrouvé de colonisation par Helicobacter pylori. Les résultats de notre étude corroborent les données actuelles de la littérature avec une surreprésentation des symptômes digestifs (Buie et al., 2010 ; Ferguson et al., 2019 ; Leader et al., 2020 ; Molloy & Manning-Courtney, 2003), ainsi qu’une prévalence supérieure de lésions digestives inflammatoires et chroniques en population avec TSA : œsophagite, gastrite, duodénite,
et maladie inflammatoire chronique de l’intestin (MICI). Il y aurait un intérêt pour les enfants et adolescents avec TSA, déficience intellectuelle et troubles du comportement, à élargir l’indication de fibroscopie œso-gastro-duodénale sous anesthésie générale.
Face à des troubles du comportement dans cette population, l’enjeu est de différencier les troubles du comportement :
– d’origine développementale, en lien avec les spécificités du TSA et surtout en lien avec le niveau de développement du sujet (notamment en cas de déficience intellectuelle associée) ;
– d’origine somatique : épilepsie, douleur ;
– d’origine psychiatrique : comorbidités psychiatriques se surajoutant au TSA et/ou à la déficience intellectuelle ;
– d’origine iatrogénique ;
– d’origine environnementale, avec en particulier la mise en place d’une communication déviante (inappropriée) (Guinchat et al., 2015 ; Guinchat et al., 2020).
Comment savoir si la cause est somatique et qu’il s’agit de rechercher une étiologie algique et non pas de s’orienter vers une cause psycho-éducative ou développementale ?
Plusieurs éléments sont évocateurs d’une cause somatique et doivent faire rechercher des douleurs, en particulier lorsque :
– il y a des causes connues de douleur à traiter ;
– on a l’impression que le sujet est algique ;
– les troubles du comportement surviennent de manière non contextualisable, i.e. de façon impromptue, sans raison évidente, sans lien avec l’environnement ;
– en cas d’auto-agressivité et/ou d’automutilations : la fréquence, la temporalité, la durée, et la topographie des lésions peuvent être évocatrices de certaines causes algiques, de même que la séméiologie et l’association de certains troubles du comportement (Figure 2, Tableau 2).
Figure 2 : La plupart des sujets avec TSA (et déficience intellectuelle) agités et violents sont gênés ou douloureux
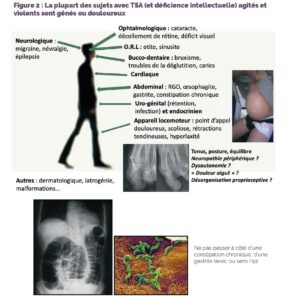
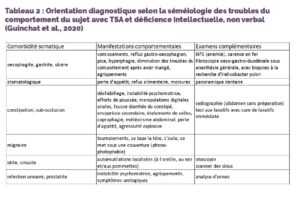
Tableau 2 : Orientation diagnostique selon la séméiologie des troubles du comportement du sujet avec TSA et déficience intellectuelle, non verbal (Guinchat et al., 2020)
Une évaluation clinique systématique devrait viser à identifier les différentes sources d’inconforts somatiques et de douleurs, et la façon dont les patients avec TSA et déficience intellectuelle « agissent » ou expriment leur douleur, que ce soit par :
• des stratégies pour éviter la douleur ou l’inconfort : par exemple, un patient avec TSA très constipé ou ballonné qui tente de soulager son inconfort autant que possible en se déshabillant, parce que les bandes élastiques des vêtements ou les ceintures sont gênantes et que ces patients sont moins contraints par les normes sociales ;
• une communication inappropriée, comme des comportements inexpliqués (retrait, opposition, agrippements, agressivité), causés en partie par l’incapacité de certains enfants autistes à verbaliser leur douleur et à pouvoir rechercher un soulagement de manière adéquate. Par exemple, un patient peut saisir un soignant (bras et/ou cheveux) pendant une gastrite ou une infection des voies urinaires/prostatite pour demander de l’aide ;
• une augmentation du stress et de l’irritabilité liés à la sensation douloureuse (Goodland, 2001), aggravant les capacités de communication (Barney et al., 2009) ;
• une stimulation du système nerveux sympathique (ex : hypotension orthostatique, labilité tensionnelle, tachycardie, transpiration) ou des manifestations qui génèrent elles-mêmes une anxiété importante (Ferguson et al., 2017 ; Schlereth & Birklein, 2008) ;
• une sensibilité réduite aux signaux corporels, une désorganisation de l’intégration sensorimotrice par la douleur elle-même (Bennett, 1999) ou une dysrégulation du système nerveux autonome (Mazurek et al., 2013 ; Woodard et al., 2012) peuvent augmenter les comportements adaptatifs ;
• un changement d’état de vigilance et une confusion dus à une condition médicale (comme dans les états délirants) ou à une médication psychotrope excessive.
Le Tableau 2 résume, parmi les comorbidités organiques, les principales étiologies algiques dans cette population, leurs manifestations comportementales, et les examens cliniques et paracliniques à réaliser pour les rechercher (Guinchat et al., 2020). Les examens ORL, dentaires, abdominaux, gastroentérologiques, dermatologiques et urologiques sont essentiels (Buie et al., 2010 ; De Winter et al., 2011).
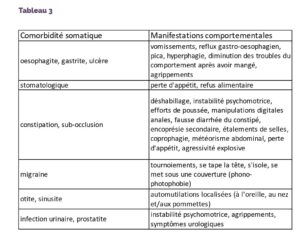
Les principaux points-clés à retenir concernant notre propos sont synthétisés dans le Tableau 3.
Tableau 3
Conclusion
Nous nous sommes, dans cet exposé, particulièrement intéressés à des enfants et adolescents dont les troubles neuro-développementaux sont sévères et complexes, et chez lesquels la survenue et l’installation de pathologies algiques sont susceptibles d’altérer et de modifier les expressions de la douleur auxquelles nous sommes habituellement confrontés.
L’échange et l’expression verbale y sont souvent, de principe, très limités ; l’expression gestuelle souvent restreinte, parfois atypique et déroutante, voire inquiétante dans les cas d’automutilation. Si l’assistance présente aujourd’hui est formée à ces rencontres avec ces jeunes patients, il faut bien reconnaître que l’a priori qu’il s’agisse de manifestations psychiatriques chez de tels enfants atypiques est en pratique souvent le premier réflexe chez le clinicien peu habitué à rencontrer ces situations, et que cela conduit souvent à méconnaître ou à différer la recherche d’étiologies somatiques, ainsi qu’à majorer des prescriptions inadaptées de psychotropes.
Nous avons ainsi passé en revue dans cette présentation des particularités possibles d’expression et de comportements chez ces jeunes patients, des aménagements éventuels à apporter au cadre et aux modalités des examens, et nous avons rapporté les pathologies somatiques algiques fréquemment retrouvées tant dans notre pratique que dans la littérature récente.
Références
• APA. (2013). Diagnostic and Statistical Manual of Mental Disorders Fifth Edition. In. Washington DC. American Psychiatric Press.
• Barney, C. C., Breau, L. M., Salsman, S., Sarsfield-Turner, T., & Mullan, R. (2009). Pilot study of the feasibility of the non-communicating children’s pain checklist revised for pain assessment for adults with intellectual disabilities J. Pain Manag., 2(1), 37-49.
• Bennett, R. M. (1999). Emerging concepts in the neurobiology of chronic pain: evidence of abnormal sensory processing in fibromyalgia. Mayo Clin Proc, 74(4), 385-398. https://doi.org/10.4065/74.4.385.
• Buie, T., Campbell, D. B., Fuchs, G. J., 3rd, Furuta, G. T., Levy, J., Vandewater, J., . . . Winter, H. (2010). Evaluation, diagnosis, and treatment of gastrointestinal disorders in individuals with ASDs: a consensus report. Pediatrics, 125 Suppl 1, S1-18. https://doi.org/10.1542/
peds.2009-1878C.
• Cohen, D., Raffin, M., Canitano, R., Bodeau, N., Bonnot, O., Périsse, D., . . . Laurent, C. (2013). Risperidone or aripiprazole in children and adolescents with autism and/or intellectual disability: A Bayesian meta-analysis of efficacy and secondary effects. Research in Autism Spectrum Disorders, 7(1), 167-175. https://doi.org/10.1016/j.rasd.2012.08.001.
• CRAIF. (2020). CRAIF, CREAI et ARSIF. Faciliter la réalisation des tests nasopharyngés auprès des personnes TSA-TND. https://www.iledefrance.ars.sante.fr/system/files/2020-04/covid19-test-TSA.pdf.
• Cravero, C., Guinchat, V., Claret-Tournier, A., Sahnoun, C., Bonniau, B., Bodeau, N., . . .Chamak, B. (2017). Traitements médicamenteux reçus par les enfants, adolescents et jeunes adultes avec trouble du spectre autistique en France : un état des lieux basé sur l’expérience parentale. Neuropsychiatr Enfance Adolesc, 65, 33-41.
• De Winter, C. F., Jansen, A. A., & Evenhuis, H. M. (2011). Physical conditions and challenging behaviour in people with intellectual disability: a systematic review. J Intellect Disabil Res, 55(7), 675-698. https://doi.org/10.1111/j.1365-2788.2011.01390.x.
• Dubois, A., Rattaz, C., Pry, R., & Baghdadli, A. (2010). [Autism and pain – a literature review]. Pain Res Manag, 15(4), 245-253. https://doi.org/10.1155/2010/749275 (Autisme et douleur – analyse bibliographique.).
• Dunn, W. (1999). Sensory profile (P. Corporation, Ed.).
• Ferguson, B. J., Dovgan, K., Takahashi, N., & Beversdorf, D. Q. (2019). The Relationship Among Gastrointestinal Symptoms, Problem Behaviors, and Internalizing Symptoms in Children and Adolescents With Autism Spectrum Disorder. Front Psychiatry, 10, 194.
https://doi.org/10.3389/fpsyt.2019.00194.
• Ferguson, B. J., Marler, S., Altstein, L. L., Lee, E. B., Akers, J., Sohl, K., . . . Beversdorf, D. Q. (2017). Psychophysiological Associations with Gastrointestinal Symptomatology in Autism Spectrum Disorder. Autism Res, 10(2), 276-288. https://doi.org/10.1002/aur.1646.
• Frey, H. P., Molholm, S., Lalor, E. C., Russo, N. N., & Foxe, J. J. (2013). Atypical cortical representation of peripheral visual space in children with an autism spectrum disorder. Eur J Neurosci, 38(1), 2125-2138. https://doi.org/10.1111/ejn.12243.
• Gaines, K., Bourne, A., Pearson, M., & Kleibrink, M. (2018). Designing for Autism Spectrum Disorders (Routledge, Ed.).
• Goodland, D. G. (2001). Chronic pain, disability, and depression: An old problem, a new understanding. (Publication Number 7196) University of Windsor].
• Granpeesheh, D., Tarbox, J., & Dixon, D. R. (2009). Applied behavior analytic interventions for children with autism: a description and review of treatment research. Ann Clin Psychiatry, 21(3), 162-173.
• Guinchat, V., Cravero, C., Diaz, L., Perisse, D., Xavier, J., Amiet, C., . . . Consoli, A. (2015). Acute behavioral crises in psychiatric inpatients with autism spectrum disorder (ASD): recognition of concomitant medical or non-ASD psychiatric conditions predicts enhanced improvement. Res Dev Disabil, 38, 242-255. https://doi.org/10.1016/j.ridd.2014.12.020.
• Guinchat, V., Cravero, C., Lefèvre-Utile, J., & Cohen, D. (2020). Multidisciplinary treatment plan for challenging behaviors in neurodevelopmental disorders. Handb Clin Neurol, 174, 301-321. https://doi.org/10.1016/b978-0-444-64148-9.00022-3.
• Hutchins, T. L., & Prelock, P. A. (2014). Using communication to reduce challenging behaviors in individuals with autism spectrum disorders and intellectual disability. Child Adolesc Psychiatr Clin N Am, 23(1), 41-55. https://doi.org/10.1016/j.chc.2013.07.003.
• Kloeckner, A., Jutard, C., Bullinger, A., Nicoulaud, L., Tordjman, S., & Cohen, D. (2009). Intérêt de l’abord sensorimoteur dans les pathologies autistiques sévères I : introduction aux travaux d’André Bullinger. Neuropsychiatrie de l’enfance et de l’adolescence, 57,
154-159.
• Leader, G., Tuohy, E., Chen, J. L., Mannion, A., & Gilroy, S. P. (2020). Feeding Problems, Gastrointestinal Symptoms, Challenging Behavior and Sensory Issues in Children and Adolescents with Autism Spectrum Disorder. J Autism Dev Disord, 50(4), 1401-1410.
https://doi.org/10.1007/s10803-019-04357-7.
• Lefèvre-Utile, J., Guinchat, V., Wachtel, L. E., Cohen, D., Perron, A., Montreuil, M., . . . Reyre, A. (2018a). Équipements de protection individuelle et outils de sécurisation alternatifs à la contention dans la prise en charge des troubles graves du comportement des
personnes avec autisme et déficience intellectuelle (partie 1 : perspective des patients) Personal protective equipment and restraints alternatives in the management of challenging behaviors in inpatients with autism and intellectual disability (Part 1: Patients’perspectives). Neuropsychiatr Enfance Adolesc, 66, 443-459.
• Lefèvre-Utile, J., Guinchat, V., Wachtel, L. E., Cohen, D., Perron, A., Montreuil, M., . . .Reyre, A. (2018b). Équipements de protection individuelle et outils de sécurisation alternatifs à la contention dans la prise en charge des troubles graves du comportement
des personnes avec autisme et déficience intellectuelle (partie 2 : perspectives des soignants). Neuropsychiatr Enfance Adolesc, 66(7-8), 460-467.
• Liberté, C. G. d. L. d. P. d. (2013). Rapport de visite des Services de pédopsychiatrie et de psychiatrie adulte de l’hôpital de la Pitié-Salpêtrière (Paris). http://www.cglpl.fr/
wp-content/uploads/2016/02/Rapport-de-visite-des-services-de-psychiatrie-delhôpital-de-la-Pitié-Salpêtrière-Paris.pdf.
• Malik, P., Ferraz Dos Santos, B., Girard, F., Hovey, R., & Bedos, C. (2021). Physical Constraint in Pediatric Dentistry: The Lived Experience of Parents. JDR Clin Trans Res, 23800844211041952. https://doi.org/10.1177/23800844211041952.
• Mazurek, M. O., Vasa, R. A., Kalb, L. G., Kanne, S. M., Rosenberg, D., Keefer, A., . . . Lowery, L. A. (2013). Anxiety, sensory over-responsivity, and gastrointestinal problems in children with autism spectrum disorders. J Abnorm Child Psychol, 41(1), 165-176. https://doi.
org/10.1007/s10802-012-9668-x.
• Molloy, C. A., & Manning-Courtney, P. (2003). Prevalence of chronic gastrointestinal symptoms in children with autism and autistic spectrum disorders. Autism, 7(2), 165-171. https://doi.org/10.1177/1362361303007002004.
• PCMA. (2021). L’Association de Gestion Professionnelle de Crise. Prévenir, Désamorcer et Gérer des Comportements Dangereux. https://pcmafrance.com/.
• Posar, A., & Visconti, P. (2018). Sensory abnormalities in children with autism spectrum disorder. J Pediatr (Rio J), 94(4), 342-350. https://doi.org/10.1016/j.jped.2017.08.008
• Santé, H. A. d. (2012). Autisme et autres troubles envahissants du développement : interventions éducatives et thérapeutiques coordonnées chez l’enfant et l’adolescent.
Recommandations par consensus formalisé. https://www.has-sante.fr/upload/docs/application/pdf/2012-03/recommandations_autisme_ted_enfant_adolescent_interventions.pdf.
• Santé, H. A. d. (2018). Trouble du spectre de l’autisme : signes d’alerte, repérage, diagnostic et évaluation chez l’enfant et l’adolescent. Recommandations pour la pratique clinique. https://www.has-sante.fr/upload/docs/application/pdf/2018-02/trouble_du_spectre_de_lautisme_de_lenfant_et_ladolescent__recommandations.pdf.
• Schlereth, T., & Birklein, F. (2008). The sympathetic nervous system and pain. Neuromolecular Med, 10(3), 141-147. https://doi.org/10.1007/s12017-007-8018-6.
• Verpoorten, R., Noens, I., & van Berckelaer-Onnes, I. (2012). ComFor 2 : outil d’évaluation des précurseurs de la communication (H. Netherland, Ed.).
• White, E. N., Ayres, K. M., Snyder, S. K., Cagliani, R. R., & Ledford, J. R. (2021). Augmentative and Alternative Communication and Speech Production for Individuals with ASD: A Systematic Review. J Autism Dev Disord, 51(11), 4199-4212. https://doi.org/10.1007/
s10803-021-04868-2.
• Whitney, D. G., & Shapiro, D. N. (2019). National Prevalence of Pain Among Children and Adolescents With Autism Spectrum Disorders. JAMA Pediatr. https://doi.org/10.1001/jamapediatrics.2019.3826.
• Woodard, C. R., Goodwin, M. S., Zelazo, P. R., Aube, D., Scrimgeour, M., Ostholthoff, T., & Brickley, M. (2012). A comparison of autonomic, behavioral, and parent-report measures of sensory sensitivity in young children with autism. Research in Autism Spectrum Disorders, 6(3), 1234-1246. https://doi.org/10.1016/j.rasd.2012.03.012.
MàJ mars 2023
